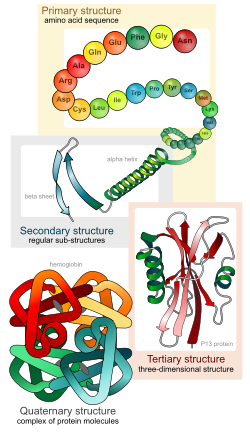
 Cấu trúc protein
Cấu trúc protein từ cấu trúc bậc 1 tới cấu trúc bậc 4.
Protein (Protid hay Đạm) là những đại phân tử được cấu tạo theo nguyên tắc đa phân mà các đơn phân là amino acid. Chúng kết hợp với nhau thành một mạch dài nhờ các liên kết peptide (gọi là chuỗi polypeptide). Các chuỗi này có thể xoắn cuộn hoặc gấp theo nhiều cách để tạo thành các bậc cấu trúc không gian khác nhau của protein.
Protein là một hợp chất đại phân tử được tạo thành từ rất nhiều những đơn phân là những amino acid. amino acid được cấu trúc bởi ba thành phần : một là nhóm amine ( – NH2 ), hai là nhóm carboxyl ( – COOH ) và ở đầu cuối là nguyên tử cacbon TT đính với 1 nguyên tử Hydro và nhóm đổi khác R quyết định hành động đặc thù của amino acide. Người ta đã phát hiện ra có hơn 20 loại amino acid trong thành phần của tổng thể những loại protein khác nhau trong khung hình sống .
Cấu tạo hóa học[sửa|sửa mã nguồn]
- Là hợp chất hữu cơ gồm 4 nguyên tố cơ bản C, H, O, N thường có thêm S và đôi lúc có P.
- Thuộc loại đại phân tử, phân tử lớn nhất dài 0,1 micromet, phân tử lượng có thể đạt tới 1,5 triệu đ.v.C.
- Thuộc loại đa phân tử, đơn phân là các amino acid.
- Có hơn 20 loại amino acid khác nhau tạo nên các prôtêin, mỗi amino acid có 3 thành phần: gốc cacbon (R), nhóm amin (-NH2) và nhóm carboxyl (-COOH), chúng khác nhau bởi gốc R. Mỗi amino acid có kích thước trung bình 3Å.
- Trên phân tử các amino acid liên kết với nhau bằng các liên kết peptide tạo nên chuỗi polypeptide. Liên kết peptide được tạo thành do nhóm carboxyl của amino acid này liên kết với nhóm amin của amino acid tiếp theo và giải phóng 1 phân tử nước. Mỗi phân tử protein có thể gồm một hay nhiều chuỗi polypeptide cùng loại.
- Từ 20 loại amino acid kết hợp với nhau theo những cách khác nhau tạo nên vô số loại prôtêin khác nhau (trong các cơ thể động vật, thực vật ước tính có khoảng 1014 – 1015 loại prôtêin). Mỗi loại prôtêin đặc trưng bởi số lượng, thành phần và trình tự sắp xếp các amino acid trong phân tử. Điều đó giải thích tại sao trong thiên nhiên các prôtêin vừa rất đa dạng, lại vừa mang tính chất đặc thù.
Cấu trúc khoảng trống[sửa|sửa mã nguồn]
Protein có 4 bậc cấu trúc cơ bản.
‘Cấu trúc bậc 1: Các amino acid nối với nhau bởi liên kết peptit hình thành nên chuỗi polypeptide. Đầu mạch polypeptide là nhóm amin của amino acid thứ nhất và cuối mạch là nhóm carboxyl của amino acid cuối cùng. Cấu trúc bậc một của protein thực chất là trình tự sắp xếp của các amino acid trên chuỗi polypeptide. Cấu trúc bậc một của protein có vai trò tối quan trọng vì trình tự các amino acid trên chuỗi polypeptide sẽ thể hiện tương tác giữa các phần trong chuỗi polypeptide, từ đó tạo nên hình dạng lập thể của protein và do đó quyết định tính chất cũng như vai trò của protein. Sự sai lệch trong trình tự sắp xếp của các amino acid có thể dẫn đến sự biến đổi cấu trúc và tính chất của protein.
Cấu trúc bậc 2 là sự sắp xếp đều đặn các chuỗi polypeptide trong không gian. Chuỗi polypeptide thường không ở dạng thẳng mà xoắn lại tạo nên cấu trúc xoắn α và cấu trúc nếp gấp β, được cố định bởi các liên kết Hydro giữa những amino acid ở gần nhau. Các protein sợi như keratin, Collagen… (có trong lông, tóc, móng, sừng)gồm nhiều xoắn α, trong khi các protein hình cầu có nhiều nếp gấp β hơn.
Cấu trúc bậc 3: Các xoắn α và phiến gấp nếp β có thể cuộn lại với nhau thành từng búi có hình dạng lập thể đặc trưng cho từng loại protein. Cấu trúc không gian này có vai trò quyết định đối với hoạt tính và chức năng của protein. Cấu trúc này lại đặc biệt phụ thuộc vào tính chất của nhóm -R trong các mạch polypeptide. Chẳng hạn nhóm -R của cystein có khả năng tạo cầu đisulfur (-S-S-), nhóm -R của prolin cản trở việc hình thành xoắn, từ đó vị trí của chúng sẽ xác định điểm gấp, hay những nhóm -R ưa nước thì nằm phía ngoài phân tử, còn các nhóm kị nước thì chui vào bên trong phân tử… Các liên kết yếu hơn như liên kết Hydro hay điện hóa trị có ở giữa các nhóm -R có điện tích trái dấu.
Cấu trúc bậc 4: Khi protein có nhiều chuỗi polypeptide phối hợp với nhau thì tạo nên cấu trúc bậc bốn của protein. Các chuỗi polypeptide liên kết với nhau nhờ các liên kết yếu như liên kết Hydro.
Liên kết peptide[sửa|sửa mã nguồn]
Liên kết peptide ( – CO-NH – ) được tạo thành do phản ứng tích hợp giữa nhóm α – carboxyl của một amino acide này với nhóm α – amin của một amino acide khác, loại đi 1 phân tử nước. Sản phẩm của phản ứng này là một dipeptide. Nếu 3, 4, 5 … v.v. hoặc nhiều amino acide phối hợp với nhau, tạo thành những peptide có những tên tương ứng là tripeptide, tetrapeptide, pentapeptide v.v. và polipeptide. Đầu bên trái peptide là đầu C, đầu bên phải peptide là đầu N. Phân tử protein được cấu trúc từ 20 L-α-amino acide những amid tương ứng .
Một số peptide tự nhiên quan trọng:
- Glutathione (tripeptide): γ – glutamyl xistiein glycin. Glutathione có trong tất cả các cơ thể sống, tham gia các phản ứng oxy hóa khử.
- Cacnoxin (dipeptide): β – alanine histidine. Cacnozin có nhiều trong cơ của động vật có xương sống (trừ một số loài cá), vai trò sinh học chưa được xác định rõ nhưng có thể tham gia các quá trình sinh hóa khi cơ hoạt động.
- Oxytocin và Vasopressin: là các notropeptide có cấu trúc có cấu trúc hóa học được biết sớm nhất và cũng đã được tổng hợp hóa học. oxytocin và vasopressin gồm 9 amino acide, trong phân tử có một cầu disulfua.
Ý nghĩa cấu trúc bậc 1 protein[sửa|sửa mã nguồn]
- Là bước đầu tiên quan trọng để xác định cơ sở phân tử hoạt tính sinh học và tính chất hóa lý của protein. Là dấu hiệu rõ nhất về sự sai khác giữa protein này với protein khác.
- Là cơ sở xác định cấu trúc không gian của phân tử protein. Từ những tư liệu về cấu trúc bậc I, trên cơ sở những quy luật hình thành cấu trúc không gian protein, dựa vào cấu trúc không gian của các protein tương đồng, có thể dự đoán sự định vị cầu disulfua, cấu trúc không gian của protein nghiên cứu.
- Là yếu tố góp phần quan trọng trong nghiên cứu bệnh lý phân tử. Nhiều kết quả nghiên cứu đã cho thấy khi thay đổi thứ tự amino acide, thậm chí thay đổi chỉ 1 gốc amino acide trong phân tử protein có thể làm thay đổi hoạt tính sinh học, chức năng của một cơ quan.
- Cấu trúc bậc I là bản phiên dịch mã di truyền. Vì vậy, cấu trúc này nói lên quan hệ họ hàng và lịch sử tiến hóa của thế giới sống.
- Việc xác định được cấu trúc bậc I là cơ sở để tổng hợp nhân tạo protein bằng phương pháp hóa học hoặc các biện pháp công nghệ sinh học.
Sự hình thành bốn bậc cấu trúc protein[sửa|sửa mã nguồn]
Do cách link giữa những amino acide để tạo thành chuỗi polipeptide, trong mạch dài polipeptide luôn lặp lại những đoạn – CO-NH-CH -. Mạch bên của những amino acide không tham gia tạo thành bộ khung của mạch, mà ở bên ngoài mạch polipeptide .Kết quả điều tra và nghiên cứu của Paulin và Cori ( Linus Pauling, Robert Corey 1930 ) và những người khác cho thấy nhóm peptide ( – CO-NH-CH – ) là phẳng và ” cứng ” .H của nhóm – NH – luôn ở vị trí trans so với O của nhóm carboxyl. Nhưng nhóm peptide có cấu trúc hình phẳng, nghĩa là tổng thể những nguyên tử tham gia trong link peptide nằm trên cùng một mặt phẳng. Paulin và Cori đã xác lập được khoảng cách giữa N và C của link đơn ( 1,46 AO ) và khoảng cách giữa C và N trong khoảng trống. Trong link đôi – C = N -, khoảng cách này là 1,27 AO. Như vậy, link peptide có một phần của link đôi, hoàn toàn có thể hình thành dạnh enolDo đó link peptide ” cứng “, không có sự tự do quay xung quanh link này. Ngược lại, năng lực quay tự do xung quanh những liên kết nối nhóm peptide với những carbon xung quanh ( giữa C và Cα, giữa N và Cα ) là rất lớn, mạch peptide có khuynh hướng hình thành cấu trúc xoắn .
Cấu trúc bậc một : chuỗi amino acid cơ bản[sửa|sửa mã nguồn]
Từ những acid amin, nhờ link peptid nối chúng lại với nhau tạo nên chuỗi polypeptid : phần chi tiết cụ thểChuỗi polypeptid là cơ sở cấu trúc bậc I của protein. Tuy nhiên, không phải mọi chuỗi polypeptid đều là protein bậc I. Nhiều chuỗi polypeptid chỉ sống sót ở dạng tự do trong tế bào mà không tạo nên phân tử protein. Những chuỗi polypeptid có trật tự amino acid xác lập thì mới hình thành phân tử protein. Người ta xem cấu trúc bậc I của protein là trật tự những acid amin có trong chuỗi polypeptid. Thứ tự những acid amin trong chuỗi có vai trò quan trọng vì là cơ sở cho việc hình thành cấu trúc khoảng trống của protein và từ đó pháp luật đặc tính của protein. Phân tử protein ở bậc I chưa có hoạt tính sinh học vì chưa hình thành nên những TT hoạt động giải trí. Phân tử protein ở cấu trúc bậc I chỉ mang tính đặc trưng về thành phần amino acid, trật tự những amino acid trong chuỗi .Trong tế bào protein thường sống sót ở những bậc cấu trúc khoảng trống. Sau khi chuỗi polypeptid – protein bậc I được tổng hợp tại ribosome, nó rời khỏi ribosome và hình thành cấu trúc khoảng trống ( bậc II, III, IV ) rồi mới vận động và di chuyển đến nơi sử dụng triển khai tính năng của nó .
Cấu trúc bậc hai : Cuộn gấp khoảng trống[sửa|sửa mã nguồn]
Theo Paulin và Cori ( 1951 ), có 2 kiểu cấu trúc chính là xoắn α và phiến gấp nếp β .
Cấu trúc xoắn α (α helix): Đoạn mạch polipeptide xoắn chặt lại, những nhóm peptide (-CO-NH-), Cα tạo thành phần bên trong (lõi) của xoắn, các mạch bên (nhóm R) của các gốc amino acide quay ra phía ngoài.
mỗi aa được tạo bởi 3 nucleotide. Cấu trúc xoắn α được giữ vững chủ yếu nhờ liên kết hydro. Liên kết hydro được tạo thành giữa các nhóm carboxyl của 1 liên kết peptide với nhóm –NH của liên kết peptide thứ tự sau nó (cách nhau 3 gốc amino acide) trên cùng một mạch polipeptide. Tất cả các nhóm –CO-, -NH- trong liên kết peptide của mạch polipeptide đều tạo thành liên kết hydro theo cách này.
Trong cấu trúc xoắn α, cứ mỗi nhóm – CO-NH – hoàn toàn có thể tạo 2 link hydro với 2 nhóm – CO-NH – khác. Các link hydro được tạo thành với số lượng tối đa, bảo vệ độ vững chắc của cấu trúc α .Theo quy mô của Paulin và Cori, trong cấu trúc xoắn giữa 2 gốc amino acide sau đó nhau có khoảng cách dọc thep trục xoắn là 1,5 AO và góc quay 100O, 1 vòng xoắn có 3,6 gốc amino acide có chiều cao tương ứng là 5,4 AO. Chiều của vòng xoắn hoàn toàn có thể là xoắn phải ( theo chiều thuận kim đồng hồ ) hoặc xoắn trái ( ngược chiều kim đồng hồ đeo tay ). Xoắn α trong phân tử protein thường là xoắn phải. Sự tạo thành và độ bền của cấu trúc xoắn α phụ thuộc vào vào nhiều yếu tố, ví dụ thành phần và trình tự sắp xếp của những amino acide trong mạch polipeptide, pH thiên nhiên và môi trường, … Đến nay người ta đã biết được 1 số ít quy luật cơ bản để tạo thành xoắn α, Vì vậy, nếu xác lập được cấu trúc bậc I của phân tử protein thì hoàn toàn có thể Dự kiến tỉ lệ xoắn α ( % số gốc amino acide tham gia tạo thành xoắn ) và vị trí của cấu trúc xoắn α trong phân tử protein. Tỉ lệ % xoắn α trong phân tử protein khác nhau biến hóa khá nhiều .
Vi dụ trong hemoglobin và mioglobin là 75%, lozozim là 35%, kimotripsin hầu như không có xoắn α, chỉ có một phần xoắn rất ngắn ở đầu C.
Khi tạo thành cấu trúc xoắn α, năng lực làm quay mặt phẳng ánh sáng phân cực sang bên phải tăng lên, cho nên vì thế hoàn toàn có thể dựa vào tình chất này để xác lập % xoắn trong phân tử protein .
Cấu trúc phiến gấp β (β sheet): Cấu trúc phiến gấp β tìm thấy trong fiborin của tơ, nó khác với xoắn α ở một số điểm như sau
- Đoạn mạch polipeptide có cấu trúc phiến gấp β thường duỗi dài ra chú không cuộn xoắn chặt như xoắn α. Khoảng cách giữa 2 gốc amino acide kề nhau là 3,5AO.
- Liên kết hydro được tạo thành giữa các nhóm –NH- và –CO- trên 2 mạch polipeptide khác nhau, các mạch này có thể chạy cùng hướng hay ngược hướng với nhau.
- Trong phân tử của nhiều protein hình cầu cuộn chặt, còn gặp kiểu cấu trúc “quay- β”. Ở đó mạch polipeptide bị đảo hướng đột ngột. Đó là do tạo thành liên kết hydro giữa nhóm –CO của liên kết peptide thứ n với nhóm –NH của liên kết peptide thứ n+2
Cấu trúc kiểu “xoắn colagen”: Kiểu cấu trúc này tìm thấy trong phân tử colagen. Thành phần amino acide của colagen rất đặc biệt so với các proteein khác: glycin 35%, prolin 12% tổng số amino acide trong phân tử.
Ngoài ra, colagen còn chứa 2 amino acide ít gặp trong các amino acide khác là hydroxiproline và hydroxilizin. Đơn vị cấu trúc của colagen là tropocolagen bao gồm 3 mạch polipeptide bện vào nhau thành một “dây cáp” siêu xoắn (vì mỗi mạch đều có cấu trúc xoắn). 3 mạch polipeptide trong “dây cáp” nối với nhau bằng các liên kết hydro.
Liên kết hydro được tạo thành giữa những nhóm – NH – của gốc glycin trên mạch polipeptide với nhóm – CO – trong link peptide ở trên mạch polipeptide khác. Ngoài ra những nhóm hydroxyl của hydroxipoline cũng tham gia tạo thành link hydro làm tăng độ bền của cấu trúc siêu xoắn .Ngoài những kiểu cấu trúc bậc II trên, trong phân tử của nhiều protein hình cầu còn có những đoạn mạch không cấu trúc xoắn, phần vô định hoặc cuộn lộn xộn .
Cấu trúc bậc ba : Liên kết disulfid ( – S – S – )[sửa|sửa mã nguồn]
 Phân tử cystine, kết quả của sự liên kết giữa 2 phân tử cystein thông qua liên kết disulfid.
Phân tử cystine, kết quả của sự liên kết giữa 2 phân tử cystein thông qua liên kết disulfid.
Cấu trúc bậc III được giữ vững nhớ những cầu disulfua, tương tác VanderWaals, link hydro, lực ion. Vì vậy khi phá vỡ những link này phân tử duỗi ra đồng thời làm đổi khác một số ít đặc thù của nó, đặc biệt quan trọng là tính tan và hoạt tính xúc tác của nó .Cấu trúc bậc ba là dạng khoảng trống của cấu trúc bậc hai, làm cho phân tử protein có hình dạng gọn hơn trong khoảng trống. Sự thu gọn như vậy giúp cho phân tử protein không thay đổi trong môi trường tự nhiên sống. Cơ sở của cấu trúc bậc ba là link disulfid. Liên kết được hình thành từ hai phân tử cystein nằm xa nhau trên mạch peptid nhưng gần nhau trong cấu trúc khoảng trống do sự cuộn lại của mạch oevtid. Đây là link đồng nhất trị nên rất bền vững và kiên cố .Cấu trúc bậc 3 đã tạo nên TT hoạt động giải trí của hầu hết những loại enzym. Sự biến hóa cấu trúc bậc ba dẫn đến sự đổi khác hướng xúc tác của enzym hoặc mất năng lực xúc tác trọn vẹn .Ngoài link disulfit, cấu trúc bậc ba còn được không thay đổi ( vững chắc ) nhờ 1 số ít link khác như :
- Liên kết hydro: liên kết này xuất hiện khi giữa hai nhóm tích điện âm có nguyên tử hydro.
Ví dụ về cấu trúc bậc 3 như phân tử insulin là một polypeptid gồm có 51 amino acid chuỗi A có 21 gốc acid amin và chuỗi B có 30 gốc acid amin. Hai chuỗi nối với nhau bởi 2 cầu disulfid : cầu thứ nhất giữa gốc cystein ở vị trí 20 của chuỗi A và vị trí 19 của chuỗi B ; cầu thứ hai giữa gốc cystein ở vị trí thứ 7 của cả 2 chuỗi. Trong chuỗi A còn có một cầu disulfit giữa 2 gốc cystein ở vị trí thứ 6 và 11. Insulin là hoocmôn tuyến tụy tham gia điều hòa hàm lượng đường trong máu. Khi thiếu insulin, hàm lượng đường trong máu tăng cao, dẫn tới hiện tượng kỳ lạ bệnh đái đường insulin có công dụng hạ đường huyết bằng cách triển khai quy trình tổng hợp glycogen dự trữ từ glucose .
- Lực Van der Waals: là lực hút giữa hai chất hoặc hai nhóm hoá học nằm cạnh nhau ở khoảng cách 1 – 2 lần đường kính phân tử.
Lực link của những nhóm kỵ nước, những nhóm không phân cực ( – CH2 ; – CH3 ) trong vang, leucin, isoleucin, phenylalanin … Nước trong tế bào đẩy những gốc này lại với nhau, giữa chúng xảy ra những lực hút tương hỗ và tạo thành những đuôi kỵ nước trong phân tử protein. Do có cấu trúc bậc ba mà những protein có được hình thù đặc trưng và tương thích với tính năng của chúng. Ở những protein tính năng như enzym và những kháng thể, protein của mạng lưới hệ thống đông máu … trải qua cấu trúc bậc ba mà hình thành được những TT hoạt động giải trí là nơi thực thi những công dụng của protein .Domain cấu trúc ( Structural domain ) được điều tra và nghiên cứu từ 1976, đến nay người ta cho rằng sự hình thành domain rất phổ cập ở những chuỗi peptid tương đối dài. Domain cấu trúc hoàn toàn có thể được định nghĩa là những bộ phận, những khu vực trong một phân tử protein được cuộn gấp trong khoảng trống giống như một phân tử protein nhỏ hoàn hảo và thường là những nơi thực thi công dụng link, công dụng lắp ráp của phân tử protein trong hoạt động giải trí công dụng của nó. Trong nhiều protein domain gắn liền với tính năng phối hợp đặc hiệu và ở nhiều enzym được cấu trúc từ những domain thì TT hoạt động giải trí lại được sắp xếp ở biên giới của hai hay nhiều domain Sự thành thành những domain trong phân tử protein tạo ra năng lực tương tác linh động giữa những đại phân tử, năng lực cơ động, di dời tương ứng giữa những bộ phận trong quy trình triển khai tính năng sinh học. – ở những protein nguồn gốc khác nhau, nhưng có tính năng tựa như thì những domain có cấu trúc tương đối giống nhau .
Cấu trúc bậc bốn : Tổ hợp những tiểu phần[sửa|sửa mã nguồn]
Phân tử protein có cấu trúc bậc IV hoàn toàn có thể phân li thuận nghịch thành những tiểu phần đơn vị chức năng. Khi phân li, hoạt tính sinh học của nó bị biến hóa hoặc hoàn toàn có thể mất trọn vẹn. Do sống sót tương tác giữa những tiểu phần đơn vị chức năng nên khi phối hợp với một chất nào đó dù là phân tử bé cũng kéo theo những biến hóa nhất định trong cấu trúc khoảng trống của chúng .Là một trạng thái tổng hợp hình thành từ nhiều tiểu phần protein đã có cấu trúc bậc ba hoàn hảo. Một số protein có xu thế tích hợp lại với nhau thành những phức tạp, thành những đại phân tử, không kéo theo sự đổi khác về hoạt tính sinh học .
Rất nhiều trường hợp protein phải tổ hợp lại mới có hoạt tính sinh học. Trong những trường hợp này, cấu trúc bậc bốn là điều kiện để hình thành nên tính năng mới của protein.
Ví dụ về cấu trúc bậc bốn:
- Hemoglobin (Huyết sắc tố) gồm 4 tiểu phần protein: hai tiểu phần α và hai tiểu phần β. Nếu 4 tiểu phần tách rời nhau thì mỗi tiểu phần không thể vận chuyển được một phân tử O2 Khi kết hợp lại thành trạng thái tetramer tạo thành một khối không gian đặc thù gần như hình tứ diện thì mới có khả năng kết hợp và vận chuyển khí oxy. Một phân tử hemoglobin (Hít) vận chuyển được 4 phân tử oxy.
- Enzym glycogen phosphorylase (ở cơ, gan) xúc tác quá trình phân giải glycogen thành glucose.
- Ở trạng thái không hoạt động enzym này ở dạng “b” (dạng hai dimer tách rời nhau).
- Ở trạng thái hoạt động (khi có tín hiệu cần đường) hai dimer tổ hợp lại thành tetramer (dạng “a”). Khi nhu cầu giải phóng glucose giảm, tetramer lại tách thành hai dimer, enzym trở lại dạng không hoạt động.
Tùy theo protein mà số lượng monomer hoàn toàn có thể đổi khác từ 2,4,6,8 là thông dụng, riêng biệt hoàn toàn có thể lên tới trên 50 monomer .
Sự hình thành cấu trúc bậc bốn tạo điều kiện kèm theo cho quy trình điều tiết sinh học thêm phức tạp, đúng mực .

 Cấu trúc protein từ cấu trúc bậc 1 tới cấu trúc bậc 4.
Cấu trúc protein từ cấu trúc bậc 1 tới cấu trúc bậc 4.
 Phân tử cystine, kết quả của sự liên kết giữa 2 phân tử cystein thông qua liên kết disulfid.
Phân tử cystine, kết quả của sự liên kết giữa 2 phân tử cystein thông qua liên kết disulfid.




