Bài 24 Hóa 10 trang 108: Sơ lược về hợp chất có oxi của clo. Giải bài 1, 2,3,4,5 trang 108.
Bài 1. Chọn câu đúng cho các câu sau:
A. Clorua – vôi là muối tạo bởi một sắt kẽm kim loại link với một loại gốc axit .
B. Clorua- vôi là muối tạo bởi một kim loại liên kết với hai loại gốc axit.
C. Clorua – vôi là muối tạo bởi hai sắt kẽm kim loại link với một loại gốc axit .
D. Clorua-vôi không phải là muối .
Bài 2. Nêu tính chất hóa học chính và ứng dụng của nước Gia- ven, clorua vôi.
Đáp án:
a ) Tính chất hóa học của nước Gia-ven
– Nước Gia-ven là hỗn hợp muối NaCl và NaClO là muối của axit yếu, trong không khí công dụng với CO2 cho HClO không bền có tính oxihóa mạnh .
NaClO + CO2 + H2O → NaHCO3 + HClO
2HC lO → 2HC l + O2
– Nước Gia – ven không để được lâu, có tính oxihóa mạnh .
b ) Tính chất hóa học của clorua vôi
– Clorua có tính oxihóa mạnh, khi công dụng với dung dịch HCl giải phóng khí Clo :
CaOCl2 + 2HC l → CaCl2 + Cl2 ↑ + H2O
– Trong không khí ẩm, clorua vôi công dụng với CO2
2C aOCl2 + CO2 + H2O → CaCO3 ↓ + CaCl2 + 2HC lO
c ) Ứng dụng của nước Giaven và cloruavôiQuảng cáo
– Ứng dụng của nước Giaven
Dùng để tẩy trắng sợi vải, giấy. Nó cũng được dùng để khử mùi, sát trùng khi tẩy uế Tolet hoặc những khu vực bị ô nhiễm khác .
– Ứng dụng của cloruavôi :
Cũng dùng để tẩy trắng sợi vải, giấy, để tẩy uế những hố rác, cống rãnh. Do năng lực tính năng nhiều với chất hữu cơ, clorua-vôi dùng để xử lí những chất độc. Một lượng lớn clorua-vôi được dùng trong việc tinh chế dầu mỏ
Bài 3. Trong phòng thí nghiệm có các hóa chất: NaCl, MnO2, NaOH và H2SO4 đặc ta có thể điều chế được nước Gia-ven không? Viết phương trình hóa học của các phản ứng.
– Điều chế HCl từ NaCl, H2SO4 đặc, H2O
NaCl + H2SO4 NaHSO4 + HCl ↑
Hấp thụ khí hidro clorua vào nước được dung dịch axit HCl .
– Từ axit HCl và MnO2 điều chế Cl2
MnO2 + 4HC l → MnCl2 + 2H2 O + Cl2
– Từ Cl2 và dung dịch NaOH điều chế nước Gia-ven
Cl2 + 2NaOH → NaCl + NaClO + H2O
Bài 4. Có những sơ đồ phản ứng hóa học sau:
Quảng cáo
a ) Cl2 + H2O → HCl + HClO
b ) CaOCl2 + HCl → CaCl2 + Cl2 + H2O
c ) Cl2 + KOH → KCl + KClO3 + H2O
d ) HCl + KClO3 → KCl + Cl2 + H2O
e ) NaClO + CO2 + H2O → NaHCO3 + HClO
g ) CaOCl2 → CaCl2 + O2
Cho biết những phản ứng nào là phản ứng oxihóa khử và vai trò của những chất tham gia phản ứng oxi-hóa khử. Hoàn thành phương trình hóa học .
Giải bài 4: Những phản ứng sau là phản ứng oxi-hóa-khử:
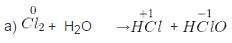
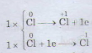 Cl2 vừa là chất khử vừa là chất oxi hóa.
Cl2 vừa là chất khử vừa là chất oxi hóa.
b) 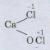 + 2HCl → CaCl2 + Cl2 + H2O
+ 2HCl → CaCl2 + Cl2 + H2O
CaOCl2 : phân tử tự oxi hóa khử, HCl đóng vai trò môi trường tự nhiên

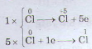 Cl2 vừa là chất oxi hóa, vừa là chất khử.
Cl2 vừa là chất oxi hóa, vừa là chất khử.
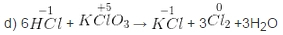
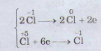 HCl là chất khử, KClO3 là chất oxi hóa
HCl là chất khử, KClO3 là chất oxi hóa
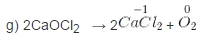
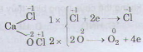 CaOCl2: phân tử tự oxi hóa
CaOCl2: phân tử tự oxi hóa
Bài 5. Trong phòng thí nghiệm có canxi oxit, nước, MnO2, axit H2SO4 70% (D = 1,61g/cm3) và NaCl. Hỏi cần phải dùng những chất gì và với lượng chất là bao nhiêu để điều chế 254 g clorua vôi?

Phương trình hóa học của phản ứng :
CaO + H2O → Ca ( OH ) 2
2 mol 2 mol
NaCl + H2SO4 → t0 NaHSO4 + HCl
8 mol 8 mol
MnO2 + 4HC l → MnCl2 + Cl2 + 2H2 O
2 mol 8 mol ← 2 mol
Cl2 + Ca ( OH ) 2 → CaOCl2 + H2O
2 mol ← 2 mol ← 2 mol
Khối lượng các chất:

nNaCl = 8 mol → mNaCl = 8 x 58,5 = 468 g
nCaO = 2 mol → mCaO = 56 x 2 = 112 g

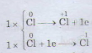 Cl2 vừa là chất khử vừa là chất oxi hóa.
Cl2 vừa là chất khử vừa là chất oxi hóa. + 2HCl → CaCl2 + Cl2 + H2O
+ 2HCl → CaCl2 + Cl2 + H2O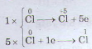 Cl2 vừa là chất oxi hóa, vừa là chất khử.
Cl2 vừa là chất oxi hóa, vừa là chất khử.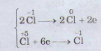 HCl là chất khử, KClO3 là chất oxi hóa
HCl là chất khử, KClO3 là chất oxi hóa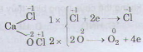 CaOCl2: phân tử tự oxi hóa
CaOCl2: phân tử tự oxi hóa






