Các loại và ví dụ về phản ứng thay thế
các phản ứng thế kép, của sự dịch chuyển kép hoặc sự đo lường, là một trong đó sự trao đổi ion kép xảy ra giữa hai hợp chất, mà không có bất kỳ sự oxy hóa hoặc khử nào. Đây là một trong những phản ứng hóa học cơ bản nhất.
Các link mới được hình thành bởi lực hút tĩnh điện lớn giữa những ion. Ngoài ra, phản ứng ủng hộ sự hình thành những loài không thay đổi hơn, ví dụ điển hình như phân tử nước, là hầu hết. Phương trình hóa học chung cho phản ứng thế kép được minh họa trong hình dưới .
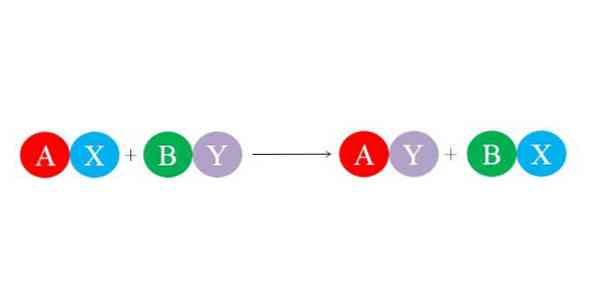
Các hợp chất bắt đầu AX và BY phản ứng bằng cách trao đổi ” đối tác chiến lược của chúng ” và do đó tạo thành hai hợp chất mới : AY và BX. Phản ứng này xảy ra khi và chỉ khi A và Y tương quan nhiều hơn A và B, hoặc nếu những link BX không thay đổi hơn so với BY. Vì phản ứng là sự trao đổi đơn thuần của những ion, nên không có sự tăng hoặc giảm electron nào ( phản ứng oxi hóa khử ) .Do đó, nếu A là cation điện tích + 1 trong hợp chất AX, thì nó sẽ có cùng điện tích + 1 trong hợp chất AY. Điều tựa như cũng xảy ra với phần còn lại của ” những vần âm “. Loại phản ứng này là sự tương hỗ của những phản ứng axit-bazơ và sự hình thành kết tủa .Chỉ số
- 1 loại
- 1.1 Trung hòa
- 1.2 Lượng mưa
- 2 ví dụ
- 2.1 Ví dụ 1
- 2.2 Ví dụ 2
- 2.3 Ví dụ 3
- 2.4 Ví dụ 4
- 2.5 Ví dụ 5
- 2.6 Ví dụ 6
- 2.7 Ví dụ 7
- 2.8 Ví dụ 8
- 3 tài liệu tham khảo
Các loại
Trung hòa
Một axit mạnh phản ứng với một bazơ mạnh để tạo ra muối và nước hòa tan. Khi một trong hai – axit hoặc bazơ – yếu, muối tạo ra không bị ion hóa trọn vẹn ; đó là, trong một thiên nhiên và môi trường nước có năng lực thủy phân. Tương tự như vậy, axit hoặc bazơ hoàn toàn có thể được trung hòa bằng muối .Ở trên một lần nữa hoàn toàn có thể được trình diễn bằng phương trình hóa học với những vần âm AXBY. Tuy nhiên, vì độ axit Brønsted chỉ được chỉ định bởi những ion H + và OH -, những từ này đại diện thay mặt cho chữ A và Y :HX + BOH => HOH + BX Phương trình hóa học này tương ứng với sự trung hòa, đơn thuần là phản ứng giữa axit HX và bazơ BOH để tạo ra HOH ( H2O ) và muối BX, hoàn toàn có thể hoặc không hề hòa tan trong nước .Bộ xương của bạn hoàn toàn có thể biến hóa tùy theo thông số cân đối hóa học hoặc thực chất của axit ( dù là hữu cơ hay vô cơ ) .
Lượng mưa
Trong loại phản ứng này, một trong những loại sản phẩm không hòa tan trong thiên nhiên và môi trường, thường là nước và kết tủa ( chất rắn hóa từ phần còn lại của dung dịch ) .Sơ đồ như sau : hai hợp chất hòa tan, AX và BY, được trộn lẫn, và một trong những mẫu sản phẩm, AY hoặc BX, kết tủa, sẽ phụ thuộc vào vào quy tắc hòa tan :AX + BY => AY ( s ) + BXAX + BY => AY + BX ( s )Trong trường hợp cả AY và BX đều không tan trong nước, cặp ion biểu lộ tương tác tĩnh điện mạnh nhất sẽ kết tủa, hoàn toàn có thể được phản ánh một cách định lượng trong những giá trị của hằng số hòa tan ( Kps ) .Tuy nhiên, trong hầu hết những phản ứng kết tủa, một muối là hòa tan và những kết tủa khác. Cả hai phản ứng – trung hòa và kết tủa – hoàn toàn có thể xảy ra trong cùng một hỗn hợp những chất .
Ví dụ
Ví dụ 1
HCl ( ac ) + NaOH ( ac ) => H2O ( l ) + NaCl ( ac )Đây là loại phản ứng gì ? Axit clohydric phản ứng với natri hydroxit, tạo ra nước và natri clorua. Do NaCl rất dễ hòa tan trong môi trường tự nhiên nước và một phân tử nước cũng được hình thành, phản ứng của ví dụ 1 là trung hòa .
Ví dụ 2
Cu ( KHÔNG3 ) 2 ( ac ) + Na2S ( ac ) => CuS ( s ) + 2N aNO3 ( ac )
Trong phản ứng này, không có ion H+ cũng không phải OH-, và phân tử nước không được quan sát ở phía bên phải của phương trình hóa học.
Đồng ( II ) nitrat, hoặc nitrat cupric, trao đổi ion với natri sunfua. Đồng sunfua không hòa tan, kết tủa, không giống như natri nitrat, muối hòa tan .Dung dịch Cu ( NO3 ) 2 nó màu xanh, trong khi của Na2S có màu vàng. Khi cả hai được trộn lẫn, sắc tố biến mất và kết tủa CuS, đó là một chất rắn màu đen .
Ví dụ 3
CH3COOH ( ac ) + NaOH ( ac ) => CH3COONa ( ac ) + H2Ô ( l )Một lần nữa, đây là một phản ứng trung hòa. Axit axetic phản ứng với natri hydroxit để tạo thành muối natri axetat và một phân tử nước .Không giống như ví dụ 1, natri acetate không phải là muối bị ion hóa trọn vẹn, vì anion bị thủy phân : CH3COO – ( ac ) + H2Ô ( l ) < => CH3COOH ( ac ) + OH – ( ac )
Ví dụ 4
2HI ( ac ) + CaCO3 ( s ) => H2CO3 ( ac ) + CaI2 ( ac )Trong phản ứng này, mặc dầu nó có vẻ như không trung hòa, axit hydriodic phản ứng trọn vẹn với đá vôi để tạo ra axit carbonic và canxi iodide. Ngoài ra, sự giải phóng nhiệt ( phản ứng tỏa nhiệt ) phân hủy axit carbonic thành carbon dioxide và nước :H2CO3 ( ac ) => CO2 ( g ) + H2Ô ( l )Phản ứng toàn thế giới vẫn là :2HI ( ac ) + CaCO3 ( s ) => CO2 ( g ) + H2O ( l ) + CaI2 ( ac )Ngoài ra, canxi cacbonat, muối cơ bản, trung hòa axit hydriodic .
Ví dụ 5
AgNO3 ( ac ) + NaCl ( ac ) => AgCl ( s ) + NaNO3 ( ac )Bạc nitrat trao đổi ion với natri clorua, do đó tạo thành muối không hòa tan của bạc clorua ( kết tủa trắng ) và natri nitrat .
Ví dụ 6
2 giờ3PO4 ( ac ) + 3 a ( OH ) 2 ( ac ) => 6H2 O ( l ) + Ca3 ( PO4 ) 2 ( s ) Axit photphoric được trung hòa bởi canxi hydroxit, do đó tạo thành canxi photphat muối không hòa tan và sáu mol phân tử nước .Đây là một ví dụ về phản ứng thế kép của cả hai loại : trung hòa axit và kết tủa của muối không hòa tan .
Ví dụ 7
K2S ( ac ) + MgSO4 ( ac ) => K2VẬY4 ( ac ) + MgS ( s )
Kali sunfua phản ứng với magiê sunfat, các ion S kết hợp với nhau trong dung dịch2- và Mg2+ tạo thành muối magiê sunfua không hòa tan và kali sunfat muối hòa tan.
Ví dụ 8
Na2S ( ac ) + HCl ( ac ) → NaCl ( ac ) + H2S ( g )Natri sunfua trung hòa axit clohydric, tạo ra natri clorua và hydro sunfua .Trong phản ứng này không tạo thành nước ( không giống như những chất trung hòa phổ cập nhất ) nhưng phân tử hydro sunfua không điện phân, có mùi trứng thối rất không dễ chịu. H2S thoát khỏi sự hòa tan ở dạng khí và phần còn lại của loài vẫn bị hòa tan .
Tài liệu tham khảo
- Whites, Davis, Peck & Stanley. Hóa học (Tái bản lần thứ 8). Học tập CENGAGE, trang 150-155.
- Quimicas.net (2018). Ví dụ về phản ứng thay thế kép. Truy cập ngày 28 tháng 5 năm 2018, từ: quimicas.net
- Phản ứng đo lường. Truy cập ngày 28 tháng 5 năm 2018, từ: khoa học.uwaterloo.ca
- Học viện Khan. (2018). Phản ứng thay thế kép. Truy cập ngày 28 tháng 5 năm 2018, từ: khanacademy.org
- Helmenstine, Anne Marie, Tiến sĩ (Ngày 8 tháng 5 năm 2016). Định nghĩa phản ứng thay thế kép. Truy cập ngày 28 tháng 5 năm 2018, từ: thinkco.com








