Phản ứng trao đổi ion là gì? Điều kiện xảy ra phản ứng trao đổi ion? Phản ứng trao đổi ion trong dung dịch? Lý thuyết và bài tập phản ứng trao đổi ion? Ví dụ về phản ứng trao đổi ion?… Trong phạm vi bài viết dưới đây, hãy cùng DINHNGHIA.VN tìm hiểu về chủ đề phản ứng trao đổi ion là gì cùng những nội dung liên quan.
Điều kiện xảy ra phản ứng trao đổi ion
Điều kiện sống sót dung dịch như sau :
Phản ứng trao đổi ion là gì?
- Phản ứng xảy ra trong dung dịch các chất điện li là phản ứng giữa các ion .
- Phản ứng trao đổi ion trong dung dịch các chất điện li chỉ xảy ra khi các ion phối hợp được với nhau tạo thành tối thiểu một trong số các chât sau :
- Chất kết tủa.
- Chất điện li yếu.
- Chất khí.
Phản ứng thủy phân của muối
- Nước nguyên chất có pH = 7 nhưng khi nhiều muối hòa tan vào nước thì làm cho pH của nước bị đổi khác, điều đó chứng tỏ muối đã tham gia phản ứng trao đổi ion với nước làm biến hóa nồng độ \ ( H ^ { + } \ ) trong nước. Phản ứng trao đổi này của muối với nước được gọi là phản ứng thủy phân của muối .
- Môi trường dung dịch muối tạo thành phụ thuộc vào vào các gốc cation và anion cấu trúc nên muối .
- Cation của gốc bazơ mạnh là các cation của các bazơ tan như \ ( NaOH, KOH, Ca ( OH ) _ { 2 }, Ba ( OH ) _ { 2 } \ )
- Anion của gốc axit mạnh là các anion của các axit như \ ( HCl, HBr, HI, H_ { 2 } SO_ { 4 }, HNO_ { 3 } \ )

Phản ứng axit – bazơ
- Phản ứng axit – bazơ là phản ứng trong đó có sự nhường và nhận proton \ ( H ^ { + } \ )
- Phản ứng axit – bazơ xảy ra theo chiều Axit mạnh + Bazơ mạnh \ ( \ rightarrow \ ) Axit yếu hơn + Bazơ yếu hơn .
Chú ý: Các trường hợp ngoại lệ
- Tạo thành kết tủa khó tan phản ứng vẫn xảy ra được dù axit hoặc bazơ tạo thành mạnh hơn bắt đầu
\ ( CuSO_ { 4 } + H_ { 2 } S \ rightarrow CuS + H_ { 2 } SO_ { 4 } \ ) ( CuS rất khó tan )
- Axit khó bay hơi đẩy được axit dễ bay hơi ( cả 2 axit đều mạnh )
\ ( H_ { 2 } SO_ { 4 } + NaCl \ rightarrow NaHSO_ { 4 } + HCl \, ( < 250 ^ { \ circ } C ) \ )
Thứ tự phản ứng axit – bazơ (quy luật cạnh tranh)
- Khi cho dung dịch chứa 1 axit vào dung dịch chứa nhiều bazơ
Nguyên tắc: Các bazơ sẽ phản ứng theo thứ tự: axit + bazơ mạnh trước sau đó đến lượt axit + bazơ yếu (nếu axit nhiều thì có thể coi các bazơ phản ứng đồng thời).
Ví dụ 1: Khi cho từ từ dung dịch HCl vào dung dịch chứa đồng thời chứa NaOH và \(NaALO_{2}\)
\ ( HCl + NaOH \ rightarrow H_ { 2 } O + NaCl \ ) ( khởi đầu không thấy có hiện tượng kỳ lạ kết tủa )
\ ( H_ { 2 } O + HCl + NaAlO_ { 2 } \ rightarrow Al ( OH ) _ { 3 } + NaCl \ ) ( Open kết tủa và kết tủa tăng dần )
\ ( 3HC l + Al ( OH ) _ { 3 } \ rightarrow AlCl_ { 3 } + 3H _ { 2 } O \ ) ( kết tủa tan đến hết )
- Khi cho dung dịch chứa 1 bazơ vào dung dịch có chứa nhiều axit
Nguyên tắc: Các axit sẽ phản ứng theo thứ tự từ mạnh đến yếu. Nếu bazơ nhiều thì coi các phản ứng xảy ra đồng thời.
Ví dụ 2: Cho từ từ dung dịch NaOH vào dung dịch chứa đồng thời cả HCl và \(AlCl_{3}\)
\ ( NaOH + HCl \ rightarrow NaCl + H_ { 2 } O \ ) ( không có kết tủa Open )
\ ( 3N aOH + AlCl_ { 3 } \ rightarrow Al ( OH ) _ { 3 } + 3N aCl \ ) ( có kết tủa Open và kết tủa tăng dần )
\ ( NaOH + Al ( OH ) _ { 3 } \ rightarrow NaAlO_ { 2 } + 2H _ { 2 } O \ ) ( kết tủa tan đến hết )
Bài tập phản ứng trao đổi ion và phương pháp giải
Dạng 1: Viết phương trình ion rút gọn
Phương pháp giải
Viết phản ứng dạng phân tử, nghiên cứu và phân tích dạng phân tử thành dạng ion. Rút gọn những ion giống nhau ở hai vế, cân đối điện tích và nguyên tử ở hai vế, thu được phương trình ion rút gọn .
Các chất kết tủa, chất khí và chất điện li yếu vẫn giữ ở dạng phân tử .
Bài 1: Viết phương trình ion rút gọn của phản ứng KOH tác dụng với HCl
Cách giải:
PTHH : \ ( KOH + HCl \ rightarrow KCl + H_ { 2 } O \ )
\ ( K ^ { + } + OH ^ { – } + H ^ { + } + Cl ^ { – } \ rightarrow KCl + H_ { 2 } O \ )
Loại bỏ các ion \ ( K ^ { + }, Cl ^ { – } \ ) ta thu được phương trình ion rút gọn .
Dạng 2: Xác định môi trường dung dịch
Phương pháp giải
- Viết phương trình điện li các chất tạo thành ion, nhận xét năng lực thủy phân trong nước của các ion vừa tạo thành .
- Ion gốc của axit yếu thủy phân trong nước tạo thiên nhiên và môi trường bazơ : \ ( CO_ { 3 } \ )
- Ion gốc của bazơ yếu thủy phân trong nước tạo thiên nhiên và môi trường axit : \ ( Cu ^ { 2 + }, Fe ^ { 3 + } ; Zn ^ { 2 + }, NH_ { 4 } … \ )
- Ion gốc của axit mạnh ( ví dụ : \ ( SO_ { 4 }, Br, Cl, NO_ { 3 }, ClO_ { 4 } … \ ) ) và ion gốc của bazơ mạnh ( ví dụ : \ ( Na ^ { + } ; K ^ { + }, Ba ^ { 2 + }, Ca ^ { 2 + }, Mg ^ { 2 + } … \ ) ) không bị thủy phân trong nước, đóng vai trò trung tính .
Bài 2: Đánh giá môi trường axit, bazơ, trung tính của các dung dịch thu được khi hòa tan các chất sau vào các cốc nước riêng biệt: \(K_{2}SO_{3}, NH_{4}Cl, NaClO_{4}\)
Cách giải:
- Chất hòa tan trong nước cho thiên nhiên và môi trường bazơ, pH > 7 là \ ( K_ { 2 } SO_ { 3 } \ )
\ ( K_ { 2 } SO_ { 3 } \ rightarrow 2K ^ { + } + SO_ { 3 } ^ { 2 – }, SO_ { 3 } ^ { 2 – } + H_ { 2 } O \ rightarrow HSO_ { 3 } ^ { – } + OH ^ { – } \ )
- Chất hòa tan trong nước cho môi trường tự nhiên axit, pH < 7 là \ ( NH_ { 4 } Cl \ )
\ ( NH_ { 4 } Cl \ rightarrow NH_ { 4 } ^ { + } + Cl ^ { – }, NH_ { 4 } ^ { + } + H_ { 2 } O \ rightarrow NH_ { 3 } + H_ { 3 } O ^ { + } \ )
- Chất hòa tan trong nước cho môi trường tự nhiên pH = 7 là \ ( NaClO_ { 4 } \ )
\ ( NaClO_ { 4 } \ rightarrow Na ^ { + } + ClO_ { 4 } ^ { – }, H ^ { + } + OH ^ { – } \ rightarrow H_ { 2 } O \ )
Dạng 3: Áp dụng định luật bảo toàn điện tích (ĐLBTĐT)
Định luật bảo toàn điện tích : “ Trong một dung dịch, tổng số mol các điện tích dương của ion dương và tổng số mol các điện tích âm của ion âm luôn luôn bằng nhau ” .
Khi cô cạn dung dịch, khối lượng chất rắn tạo ra bằng khối lượng các ion dương và ion âm có trong dung dịch ( trừ \ ( H ^ { + } + OH ^ { – } \ rightarrow H_ { 2 } O \ ) )
\ ( m_ { m } = m_ { cation / NH_ { 4 } ^ { + } } + m_ { anion } \ )
Bài 3: Một dung dịch có chứa các ion: \(Mg^{2+}, Cl^{-}, Br^{-}\)
- Nếu cho dd này tính năng với dd KOH dư thì thu được 11,6 gam kết tủa .
- Nếu cho dd này tính năng với \ ( AgNO_ { 3 } \ ) thì cần vừa đúng 200 ml dd \ ( AgNO_ { 3 } \ ) 2,5 M và sau phản ứng thu được 85,1 g kết tủa .
- Tính [ ion ] trong dd đầu ? biết \ ( V_ { dd } = 2 l \ )
- Cô cạn dung dịch khởi đầu thì thu được bao nhiêu gam chất rắn ?
Cách giải:
Phương trình ion :
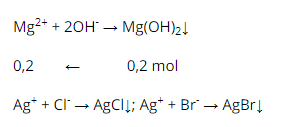
Gọi x, y lần lượt là số mol của \ ( Cl ^ { – }, Br ^ { – } \ )
Ta có :
\ ( \ left \ { \ begin { matrix } x + y = 0,5 \ \ 143,5 x + 188 y = 85,1 \ end { matrix } \ right. \ Leftrightarrow \ left \ { \ begin { matrix } x = 0,2 \ \ y = 0,3 \ end { matrix } \ right. \ )
1. \ ( [ Mg ^ { 2 + } ] = \ frac { 0,2 } { 2 } = 0,1 M \ )
\ ( [ Cl ^ { – } ] = \ frac { 0,2 } { 2 } = 0,1 M \ )
\ ( [ Br ^ { – } ] = \ frac { 0,3 } { 2 } = 0,15 M \ )
2. m = 0,2. 24 + 0,2. 35,5 + 0,3. 80 = 35,9 g
DINHNGHIA.VN đã giải đáp giúp bạn những thắc mắc về phản ứng trao đổi ion là gì, điều kiện xảy ra phản ứng trao đổi ion, phản ứng trao đổi ion trong dung dịch, cũng như lý thuyết và bài tập phản ứng trao đổi ion. Mong rằng với những kiến thức trên sẽ giúp ích cho bạn trong quá trình học tập và nghiên cứu về chủ để phản ứng trao đổi ion là gì. Chúc bạn luôn học tốt!
5
/
5
(
1
bầu chọn
)
Please follow and like us :