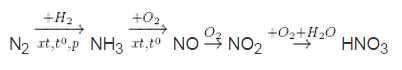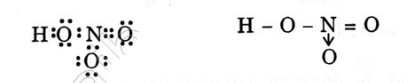[Bài 9 Hóa 11] giải bài 1, 2, 3, 4, 5, 6, 7 trang 45 SGK Hóa lớp 11: Axit nitric và muối nitrat – Chương 2
Lý thuyết cần nhớ về Axit nitric và muối nitrat
1. Trong hợp chất HNO3, nguyên tố nitơ có số oxi hóa cao nhất là + 5
2. Axit nitric tinh khiết là chất lỏng không màu, bốc khói mạnh trong không khí ẩm. Axit HNO3 tan trong nước theo bất kỳ tỉ lệ nào .
3. – Axit HNO3 là một trong các axit mạnh: làm quỳ tím hóa đỏ, tác dụng với bazơ và oxit bazơ, tác dụng với muối của axit yếu.
– Axit HNO3 là chất oxi hóa mạnh : phản ứng với hầu hết những kim loại trừ Pt và Au, 1 số ít phi kim, nhiều hợp chất vô cơ và hữu cơ. Sản phẩm khử sinh ra tùy thuộc nồng độ axit, tính khử của sắt kẽm kim loại và nhiệt độ phản ứng .
4. Trong phòng thí nghiệm axit HNO3 được điều chế bằng cách cho NaNO3 hoặc KNO3 công dụng với axit H2SO4 đăc, nóng :
2N aNO3 ( tt ) + H2SO4 ( đ ) → t0 Na2SO4 + 2HNO3
Trong công nghiệp được sản xuất theo sơ đồ sau :
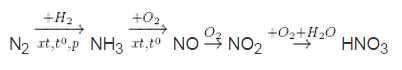
5. Tất cả những muối nitrat đều tan nhiều trong nước và là chất điện li mạnh. Các muối nitrat kém bền với nhiệt, chúng bị phân hủy khi đun nóng : muối nitrat của những sắt kẽm kim loại hoạt động giải trí mạnh ( kali, natri, … ) bị phân hủy thành muối nitrit và oxi ; muối nitrat của magie, kẽm, sắt, chì, đồng, … bị phân hủy thành oxit sắt kẽm kim loại tương ứng, NO2 và O2 ; muối nitrat của bạc, vàng, thủy ngân, … bị phân hủy thành sắt kẽm kim loại tương ứng, khí NO2 và O2 .
6. Giải được bài tập về HNO3 và NO3 – .
Giải bài tập bài 9 Hóa lớp 11 trang 45
Bài 1. Viết công thức electron, công thức cấu tạo của axit nitric. Cho biết nguyên tố nitơ có hóa trị và số oxi hóa bao nhiêu ?
Hướng dẫn :
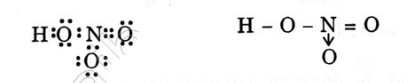
Trong HNO3, nitơ có số oxi hóa + 5 và hóa trị là 4
Bài 2 trang 45 hóa 11: Lập các phương trình hóa học:
a ) Ag + HNO3 ( đặc ) → NO2 + ? + ?
b ) Ag + HNO3 ( loãng ) → NO + ? + ?
c ) Al + HNO3 → N2O + ? + ?
d ) Zn + HNO3 → NH4NO3 + ? + ?
e ) FeO + HNO3 → NO + Fe ( NO3 ) 3 + ?
g ) Fe3O4 + HNO3 → NO + Fe ( NO3 ) 3 + ?
Hướng dẫn: Trước hết, căn cứ vào tính chất, điền công thức các chất còn thiếu ở chỗ có dấu (?). Sau đó, cân bằng pthh theo phương pháp thăng bằng electron, ta được kết quả sau:
a ) Ag + 2HNO3 ( đặc ) → NO2 + AgNO3 + H2OQuảng cáo
b ) 3A g + 4HNO3 ( loãng ) → NO + 3A gNO3 + 2H2 O
c ) 8A l + 30HNO3 → 3N2 O + 8A l ( NO3 ) 3 + 15H2 O
d ) 4Z n + 10HNO3 → NH4NO3 + 4Z n ( NO3 ) 2 + 3H2 O
e ) 3F eO + 10HNO3 → NO + 3F e ( NO3 ) 3 + 5H2 O
g ) 3F e3O4 + 28HNO3 → NO + 9F e ( NO3 ) 3 + 14H2 O
Bài 3. Hãy chỉ ra những tính chất hóa học chung và khác biệt giữa axit nitric và axit sunfuric. Viết các phương trình hóa học để minh họa.
Hướng dẫn: Axit nitric và axit sunfuric đặc đều có tính oxi hóa mạnh.
Ví dụ : 3F eO + 10HNO3 — > 3F e ( NO3 ) 3 + NO ↓ + 5H2 O
2F eO + 4H2 SO4 — > Fe2SO4 ) 3 + SO2 + 4H2 O
Tuy nhiên nếu như HNO3 loãng vẫn có tính oxi hóa thì H2SO4 loãng lại không có tính oxi hóa. Ví dụ
3F e3O4 + 28HNO3 l -> 9F e ( NO3 ) 3 + NO ↓ + 14H2 O Fe3O4 + 4H2 SO4 l — > FeSO4 + Fe2 ( S04 ) 3 + 4H2 O
Bài 4. a) Trong phương trình hóa học của phản ứng nhiệt phân sắt (III) nitrat, tổng các hệ số bằng bao nhiêu ?
A. 5 B. 7 C. 9 D. 21
b ) Trong phương trình hóa học của phản ứng nhiệt phân thủy ngân ( II ) nitrat, tổng những thông số bằng bao nhiêu ?
A. 5 B. 7 C. 9 D. 21
Đáp án bài 4:
Quảng cáo
a ) Chọn D. 21
4F e ( NO3 ) 3 → t0 2F e2O3 + 12NO2 + 3O2
b ) Chọn A. 5
Hg ( NO3 ) 3 → t0 Hg + 2NO2 + O2
Bài 5 trang 45 Hóa lớp 11: Viết phương trình hóa học của các phản ứng thực hiện dãy chuyển hóa sau đây:
NO2 → ( 1 ) HNO3 → ( 2 ) Cu ( NO3 ) 2 → ( 3 ) Cu ( OH ) 2 → ( 4 ) Cu ( NO3 ) 2 → ( 5 ) CuO → ( 6 ) Cu → ( 7 ) CuCl2
Giải bài 5:
PTHH :
4NO2 + 2H2 O -> 4HNO3
CuO + 2HNO2 -> Cu ( NO3 ) 2 + H2O
Cu ( NO3 ) 2 + 2N aOH -> Cu ( OH ) 2 ↓ + 2N aNO3
Cu ( OH ) 2 + 2HNO3 -> Cu ( NO3 ) 2 + 2H2 O
Cu ( NO3 ) 2 -> t0 CuO + 2NO2 ↑ + ½ O2 ↑
CuO + H2 -> t0 Cu + H2O
Bài 6 trang 45 Hóa lớp 11: Khi hòa tan 30,0 g hỗn hợp đồng và đồng (II) oxit trong 1,50 lít dung dịch axit nitric 1,00 M (loãng) thấy thoát ra 6,72 lít nitơ monoaxit (đktc). Xác định hàm lượng phần trăm của đồng (II) oxit trong hỗn hợp, nồng độ mol của đồng (II) nitrat và axit nitric trong dung dịch sau phản ứng, biết rằng thể tích dung dịch không thay đổi.
Lời giải bài 6:
nNO = 6,72 / 22,4 = 0,300 ( mol )
nHNO3 = 1,00 x 1,5 = 1,5 ( mol )
pthh : 3C u + 8HNO3 → 3C u ( NO3 ) 2 + 2NO + 4H2 O ( 1 )
Theo ( 1 ) ta tính được nCu = 0,45 mol => mCu = 28,8 gam
nHNO3 = 1,2 mol
nCu ( NO3 ) 2 = 0,45 mol
mCuO = 30 gam – 28,8 gam = 1,2 gam => nCuO = 0,015 mol
CuO + 2HNO3 → Cu ( NO3 ) 2 + H2O ( 2 )
Theo ( 2 ) ta tính được nHNO3 là 0,030 mol ,
nCu ( NO3 ) 2 là 0,015 mol
Phần tram khối lượng CuO : % mCuO = 1,2 / 30. 100 % = 4,0 %
Từ ( 1 ) và ( 2 ) ta tính được số mol HNO3 dư là 0,27 mol .
Nồng độ mol HNO3 sau phản ứng : 0,18 M
Nồng độ mol của Cu ( NO3 ) 2 : 0,31 M
Bài 7. Để điều chế 5,000 tấn axit nitric nồng độ 60,0 % cần dùng bao nhiêu tấn amoniac ? Biết rằng sự hao hụt amoniac trong quá trình sản xuẩ là 3,8 %.
Hướng dẫn: Tính khối lượng HNO3 nguyên chất: 3,00 tấn.
Pthh : 4NH3 + 5O2 → ( 850 – 9000C ) / Pt
4NO + 6H2 O ( 1 )
2NO + O2 → 2NO2 ( 2 )
4NO2 + O2 + 2H2O → 4HNO3 (3)
Từ những phương trình trên ta có sơ đồ hợp thức : NH3 → HNO3 ( 4 )
Theo ( 4 ), ta tính được khối lượng NH3 ( bao hụt 3,8 % ) :
( 3,00. 17,0 ) / 63,0 x ( 100 / 96,2 ) = 0,841 ( tấn )