Thuốc này để thay thế phác đồ thuốc kháng vi rút hiện tại cho những người đã sử đang sử dụng điều trị và không biết hoặc nghi ngờ kháng cabotegravir hoặc rilpivirine. Đây là phác đồ tiêm đầu tiên được FDA chấp thuận cho người lớn nhiễm HIV. Thuốc tiêm này được sử dụng mỗi tháng một lần.
FDA cũng phê duyệt Vocabria (cabotegravir, dạng viên nén), nó được dùng kết hợp với rilpivirine dạng uống (Edurant) trong một tháng trước khi bắt đầu điều trị bằng thuốc tiêm Cabenuva để đảm bảo rằng thuốc được dung nạp tốt trước khi chuyển sang dạng thuốc tiêm dạng phóng thích kéo dài.
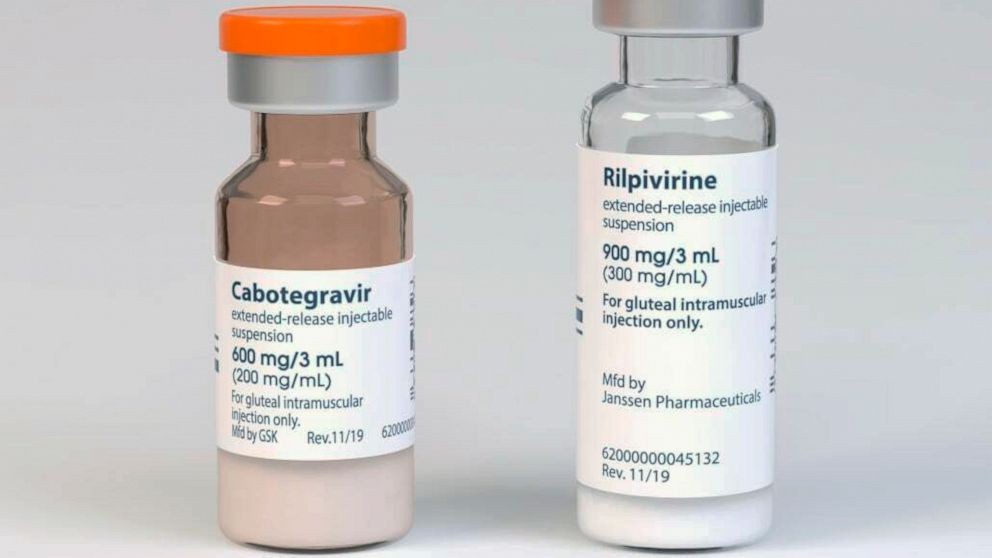
CABENUVA chứa hỗn dịch tiêm phóng thích kéo dài cabotegravir, HIV INSTI, được đóng gói cùng với hỗn dịch tiêm giải phóng kéo dài rilpivirine, HIV NNRTI.
Cabotegravir có tên hóa học của cabotegravir là (3S, 11aR) -N – [(2,4-difluorophenyl) metyl] -6-hydroxy-3-metyl-5,7-dioxo-2,3,5,7,11,11a -hexahydro [1,3] oxazolo [3,2-a] pyrido [1,2-d] pyrazine-8-carboxamide. Công thức là C19H17F2N3O5 và trọng lượng phân tử là 405,35 g/mol. Hỗn dịch tiêm giải phóng kéo dài.. Mỗi lọ đơn liều vô chứa 2 mL hoặc 3 mL các chất sau: cabotegravir 200 mg / mL và các thành phần không hoạt động sau: mannitol (35 mg / mL), polyethylene glycol (PEG) 3350 (20 mg / mL), polysorbate 20 (20 mg / mL), và Nước pha tiêm.
Rilpivirine tên hóa học của rilpivirine là 4 – [[4 – [[4 – [(E) -2-cyanoethenyl] -2,6-dimethylphenyl] amino] -2-pyrimidinyl] amino] benzonitril. Công thức phân tử của nó là C22H18N6 và trọng lượng phân tử của nó là 366,42. Rilpivirine. Hỗn dịch tiêm giải phóng kéo dài Rilpivirine là hỗn dịch để tiêm bắp. Mỗi lọ đơn liều vô trùng chứa 2 mL hoặc 3 mL sau: rilpivirine 300 mg/mL và các thành phần không hoạt động sau: axit citric monohydrat (1 mg/mL), poloxamer 338 (50 mg / mL)
“Hiện nay, tiêu chuẩn điều trị cho bệnh nhân HIV là bệnh nhân uống thuốc hàng ngày. Sự chấp thuận của FDA về việc sử dụng thuốc tiêm sẽ cho phép một số bệnh nhân lựa chọn tiêm thuốc mỗi tháng một lần thay cho chế độ điều trị bằng đường uống hàng ngày, ”John Farley, M.D., M.P.H., giám đốc Văn phòng các bệnh truyền nhiễm thuộc Trung tâm Nghiên cứu và Đánh giá Thuốc của FDA cho biết. “Việc có sẵn một loại thuốc tiêm 1 tháng một lần sẽ tạo cơ hội cho một số bệnh nhân thêm lựa chọn để kiểm soát HIV – một căn bệnh mãn tính”.
Tính an toàn và hiệu quả của Cabenuva đã được theo dõi và đánh giá thông qua hai thử nghiệm lâm sàng ngẫu nhiên có đối chứng trên 1.182 người lớn nhiễm HIV đã ức chế được tải lượng vi rút (HIV-1 RNA dưới 50 bản sao / mililit máu) trước khi bắt đầu điều trị bằng Cabenuva. Bệnh nhân trong cả hai thử nghiệm qua theo dõi cho thấy tải lượng vi rút khi tiếp tục được ức chế trong suốt quá trình theo dõi đến khi kết thúc mỗi nghiên cứu và không quan sát thấy sự thay đổi có liên quan về mặt lâm sàng so với ban đầu khi theo dõi số lượng tế bào CD4.
Các tác dụng phụ thường gặp nhất với Cabenuva là phản ứng tại chỗ tiêm, sốt (pyrexia), mệt mỏi, nhức đầu, đau cơ xương, buồn nôn, rối loạn giấc ngủ, chóng mặt và phát ban. Thuốc tiêm Cabenuva được khuyến cáo không nên sử dụng nếu đã biết trước đó có phản ứng quá mẫn với cabotegravir hoặc rilpivirine, hoặc ở những bệnh nhân chưa ức chế được tải lượng vi rút (HIV-1 RNA lớn hơn 50 bản sao/mililit).
Cabenuva và Vocabria đã được FDA cấp phép cho sử dụng là loại thuốc của hãng dược phẩm ViiV Healthcare – Một hãng dược phẩm có nhiều sản phẩm thuốc kháng HIV trong nhiều năm qua.
FDA, một cơ quan thuộc Bộ Y tế và Dịch vụ Nhân sinh Hoa Kỳ, bảo vệ sức khỏe cộng đồng bằng cách đảm bảo tính an toàn, hiệu quả và an ninh của các loại thuốc, vắc xin và các sản phẩm sinh học cũng như các thiết bị y tế cho thú y và thuốc cho con người. Cơ quan này cũng chịu trách nhiệm về sự an toàn và an ninh của nguồn cung cấp thực phẩm, mỹ phẩm, thực phẩm chức năng của Hoa Kỳ.
Bài báo gốc tại đây








